Metilgliossale
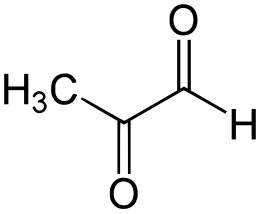
La metilgliossale (MGO) è un composto organico di formula CH3C(O)CHO, derivato ridotto dell'acido piruvico. Si tratta di un'aldeide con un gruppo chetonico come sostituente. È un composto molto reattivo legato all'insorgere e al progredire del diabete. A livello industriale si produce per degradazione di carboidrati impiegando l'enzima metilgliossal-sintasi.[1]
| Metilgliossale | |
|---|---|
 | |
| Nome IUPAC | |
| 2-ossopropanale | |
| Nomi alternativi | |
| Aldeide piruvica, piruvaldeide, acetilformaldeide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H4O2 |
| Massa molecolare (u) | 72,063 |
| Aspetto | Liquido giallo |
| Numero CAS | |
| Numero EINECS | 201-164-8 |
| PubChem | 880 |
| DrugBank | DBDB03587 |
| SMILES | CC(=O)C=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,046 |
| Temperatura di fusione | < 25 °C |
| Temperatura di ebollizione | 72 °C (~ 345 K) |
| Indicazioni di sicurezza | |
Struttura chimica
modificaLa metilgliossale gassosa presenta due gruppi carbonilici (un'aldeide e un chetone). In presenza d'acqua esiste anche sotto forma di idrati e oligomeri. La formazione degli idrati è un indice della sua elevata reattività, da tenere sotto controllo in contesti biologici.[2]
Biochimica
modificaBiosintesi e biodegradazione
modificaNegli organismi viventi la metilgliossale si forma come sottoprodotto di diversi percorsi metabolici.[3] Principalmente deriva dalla glicolisi attraverso un meccanismo che coinvolge la gliceraldeide-3-fosfato e il diidrossiacetone fosfato.[4] Si ritiene inoltre che possa originarsi dalla degradazione di acetone e treonina.[5]
La metilgliossale è molto citotossica per cui l'organismo ha sviluppato, per evoluzione, una serie di meccanismi di difesa, come gli enzimi gliossilasi. Il composto viene detossificato per azione del glutatione che, reagendo con MGO, lo converte in un emiacetale, a sua volta convertito in S-D-lattoil-glutatione tramite gliossilasi I. Il prodotto è infine convertito in lattato attraverso la gliossilasi II.[6][7]
Può formarsi anche per perossidazione lipidica oppure per metabolismo di alcuni amminoacidi, specialmente la treonina.
Funzione biochimica
modificaLa metilgliossale è coinvolta nella formazione degli advanced glycation endproducts (AGEs, prodotti finali di glicazione avanzata).[5] In questo processo, MGO reagisce con gli amminoacidi lisina, arginina e cisteina. Gli istoni sono molto suscettibili all'azione di MGO e si è visto che c'è una correlazione con l'insorgere del cancro al seno.[8][9]
Biomedicina
modificaCon l'aumentare dei livelli di glucosio nel sangue, si riscontra anche un incremento della metilgliossale, specialmente nei pazienti diabetici, in cui è associata all'aterosclerosi arteriale.[11] Questo perché MGO danneggia le LDL tramite glicazione.
MGO si lega anche direttamente alle terminazioni nervose, comportando la neuropatia diabetica.[12][13]
Miele
modificaLa metilgliossale è un componente di alcune tipologie di miele, come il miele di manuka. È utile ad esercitare un'azione contro alcuni batteri quali Escherichia coli e Staphylococcus aureus e può aiutare a prevenire la formazione di biofilm prodotti da Pseudomonas aeruginosa.[14]
Note
modifica- ^ (EN) Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, DOI:10.1002/14356007.n05_n07.
- ^ Kirsten W. Loeffler, Charles A. Koehler, Nichole M. Paul e David O. De Haan, Oligomer Formation in Evaporating Aqueous Glyoxal and Methyl Glyoxal Solutions, in Environmental Science & Technology, vol. 40, n. 20, 2006, pp. 6318-6323, Bibcode:2006EnST...40.6318L, DOI:10.1021/es060810w, PMID 17120559.
- ^ Inoue Y, Kimura A, Methylglyoxal and regulation of its metabolism in microorganisms, in Adv. Microb. Physiol., Advances in Microbial Physiology, vol. 37, 1995, pp. 177-227, DOI:10.1016/S0065-2911(08)60146-0, ISBN 978-0-12-027737-7, PMID 8540421.
- ^ (EN) Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, DOI:10.1002/14356007.a22_163.pub2.
- ^ a b Justine Bellier, Marie-Julie Nokin, Eva Lardé, Philippe Karoyan, Olivier Peulen, Vincent Castronovo e Akeila Bellahcène, Methylglyoxal, a Potent Inducer of AGEs, Connects between Diabetes and Cancer, in Diabetes Research and Clinical Practice, vol. 148, 2019, pp. 200-211, DOI:10.1016/j.diabres.2019.01.002, PMID 30664892.
- ^ Thornalley PJ, Glyoxalase I—structure, function and a critical role in the enzymatic defence against glycation, in Biochem. Soc. Trans., vol. 31, Pt 6, 2003, pp. 1343-8, DOI:10.1042/BST0311343, PMID 14641060.
- ^ Vander Jagt DL, Glyoxalase II: molecular characteristics, kinetics and mechanism, in Biochem. Soc. Trans., vol. 21, n. 2, 1993, pp. 522-7, DOI:10.1042/bst0210522, PMID 8359524.
- ^ Galligan JJ, Wepy JA, Streeter MD, Kingsley PJ, Mitchener MM, Wauchope OR, Beavers WN, Rose KL, Wang T, Spiegel DA, Marnett LJ, Methylglyoxal-derived posttranslational arginine modifications are abundant histone marks, in Proc Natl Acad Sci USA, vol. 115, n. 37, settembre 2018, pp. 9228-9233, DOI:10.1073/pnas.1802901115, PMC 6140490, PMID 30150385.
- ^ Zheng Q, Omans ND, Leicher R, Osunsade A, Agustinus AS, Finkin-Groner E, D'Ambrosio H, Liu B, Chandarlapaty S, Liu S, David Y, Reversible histone glycation is associated with disease-related changes in chromatin architecture, in Nat Commun, vol. 10, n. 1, marzo 2019, p. 1289, Bibcode:2019NatCo..10.1289Z, DOI:10.1038/s41467-019-09192-z, PMC 6426841, PMID 30894531.
- ^ Tomoko Oya, Nobutaka Hattori, Yoshikuni Mizuno, Satoshi Miyata, Sakan Maeda, Toshihiko Osawa e Koji Uchida, Methylglyoxal Modification of Protein, in Journal of Biological Chemistry, vol. 274, n. 26, 1999, pp. 18492-18502, DOI:10.1074/jbc.274.26.18492, PMID 10373458.
- ^ Rabbani N, L Godfrey, M Xue, F Shaheen, M Geoffrion, R Milne e PJ Thornalley, Glycation of LDL by methylglyoxal increases arterial atherogenicity. A possible contributor to increased risk of cardiovascular disease in diabetes, in Diabetes, vol. 60, n. 7, 26 maggio 2011, pp. 1973-80, DOI:10.2337/db11-0085, PMC 3121424, PMID 21617182.
- ^ Spektrum: Diabetische Neuropathie: Methylglyoxal verstärkt den Schmerz: DAZ.online Archiviato il 10 ottobre 2015 in Internet Archive.. Deutsche-apotheker-zeitung.de (2012-05-21). Retrieved on 2012-06-11.
- ^ Angelika Bierhaus, Thomas Fleming, Stoyan Stoyanov, Andreas Leffler, Alexandru Babes, Cristian Neacsu, Susanne K Sauer, Mirjam Eberhardt, Martina Schnölzer, Felix Lasischka, Winfried L Neuhuber, Tatjana I Kichko, Ilze Konrade, Ralf Elvert, Walter Mier, Valdis Pirags, Ivan K Lukic, Michael Morcos, Thomas Dehmer, Naila Rabbani, Paul J Thornalley, Diane Edelstein, Carla Nau, Josephine Forbes, Per M Humpert, Markus Schwaninger, Dan Ziegler, David M Stern, Mark E Cooper e Uwe Haberkorn, Methylglyoxal modification of Nav1.8 facilitates nociceptive neuron firing and causes hyperalgesia in diabetic neuropathy, in Nature Medicine, vol. 18, n. 6, 2012, pp. 926-33, DOI:10.1038/nm.2750, PMID 22581285.
- ^ ZH Israili, Antimicrobial properties of honey., in American Journal of Therapeutics, vol. 21, n. 4, 2014, pp. 304-23, DOI:10.1097/MJT.0b013e318293b09b, PMID 23782759.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su metilgliossale
| Controllo di autorità | GND (DE) 4396972-0 |
|---|