Riddelliina
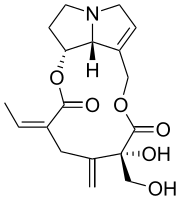
La riddelliina è un alcaloide del gruppo degli alcaloidi pirrolizidinici, isolato per la prima volta dalla pianta Senecio riddellii.[1] È il diestere della retronecina con l'acido riddellico.[1][2]
| Riddelliina | |
|---|---|
 | |
| Nomi alternativi | |
| Riddellina, Riddelina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C18H23NO6 |
| Massa molecolare (u) | 349,38 |
| Numero CAS | |
| PubChem | 5281744 |
| SMILES | O=C1OC2CCN3CC=C(COC(=O)C(O)(C(=C)CC1=CC)CO)C32 |
| Indicazioni di sicurezza | |
La riddelliina può essere trovata come contaminante in alimenti come carne, cereali, semi, latte, tisane e miele.[3]
Si sospetta che la riddelliina sia cancerogena.[4] È elencato come cancerogeno del Gruppo 2B dall'Agenzia internazionale per la ricerca sul cancro.
La riddelliina è costituita da un diestere macrociclico di retronecina (un alcol insaturo) e acido riddelliico (un acido bicarbossilico ossigenato, ramificato).[5] La riddelliina è un solido cristallino da incolore a biancastro a temperatura ambiente. È solubile in cloroformio, acetone ed etanolo ed è scarsamente solubile in acqua. Come solido, è stabile a temperatura ambiente con luce diffusa per 12 mesi o più.[5] Le soluzioni alcoliche e acquose di riddelliina sono stabili a temperatura ambiente se protette dalla luce. Emette fumi tossici di ossidi di azoto quando riscaldata fino alla decomposizione.
Storia
modificaIl primo isolamento documentato di riddelliina è stato fatto da Richard H. F. Manske, un chimico presso i National Research Laboratories di Ottawa, Ontario, Canada il 13 dicembre 1938 e pubblicato nel 17° volume, sezione B del Canadian Journal of Research, nel gennaio del 1939.[6]
La formula e la struttura son state poi confermate da Roger Adams, K.E. Hamlin, JR., C.F. Jelinek e R.F. Phillips nel Journal of the American Chemical Society 1942.[7]
Sintesi
modificaLa riddelliina è prodotta naturalmente da una varietà di piante del genere Senecio. In particolare, la Senecio riddelliispecies è composta fino al 18% in peso totale da riddelliina e dalla sua controparte N-ossido, la riddelliina N-ossido.[8]
Come altri alcaloidi pirrolizidinici, la sintesi della riddelliina comporta la conversione di ornitina e arginina in retronecina. Una sintesi tracciata mostra che l'arginina (o il suo precursore ornitina) viene convertita in putrescina, che poi viene convertita in omospermidina. L'omospermidina viene quindi ossidata in dialdeideammina, che subisce una reazione di Mannich intramolecolare per produrre trachelantammidina. La trachelantammidina viene convertita in supinidina, l'ultimo intermedio per la produzione di retronecina. La retronecina viene quindi fatta reagire con acido riddelliico per produrre riddelliina.[9]
Non è stata ancora stabilita una sintesi chimica della riddelliina.
Meccanismo
modificaLa riddelliina non è tossica, ma il suo metabolismo nel fegato contribuisce alla sua tossicità. La riddelliina può essere idrolizzata nel fegato in riddelliina N-ossido, che come la riddelliina non è una sostanza tossica. Questo percorso è considerato una reazione disintossicante. D'altra parte, la riddelliina può essere disidratata dal citocromo P450 per produrre deidroriddelliina. Due possibili percorsi emergono da questo intermedio citotossico, che producono entrambi addotti di DNA tumorigenici simili. Nessuno dei due percorsi ha dimostrato di essere il meccanismo predominante.
Il primo meccanismo prevede un movimento di elettroni intramolecolare per rompere il legame esterico. Questo crea un carbocatione che può legarsi covalentemente a una base di DNA. Idrolizzando il resto dell'acido riddelliico dalla molecola originale, la deidropirrolizina (DHP) risultante può legarsi a un'altra base di DNA, che introduce una reticolazione covalente.[10]
Il secondo meccanismo prevede l'idrolisi dell'acido riddelliico per produrre deidropirrolizina (DHP). Idrolizzando entrambi i gruppi idrossilici attaccati agli atomi di carbonio 3 e 8 di DHP, il carbocatione risultante può legarsi a due basi di DNA, producendo un altro addotto di DNA.[10]
In entrambi i casi, la molecola di DHP legata in modo covalente può essere ulteriormente modificata per indurre un legame covalente più forte. Ad oggi, sono stati osservati 8 addotti del DNA derivati dal DHP, che contribuiscono tutti alla cancerogenicità della riddelliina.[10]
Effetti collaterali
modificaMalattie
modificaNell'uomo è stata osservata una malattia veno occlusiva epatica acuta dopo il consumo di un preparato a base di erbe contenente riddelliina.[11]
Genotossicità
modificaIn un sistema in vitro, l'esposizione alla riddelliina ha causato lo scambio di cromatidi fratelli nei linfociti umani, il cross linking DNA-proteina nelle cellule epiteliali del rene bovino e mutazioni geniche nei batteri.[11]
Cancerogenicità
modificaNon ci sono dati sulla cancerogenicità della riddelliina per l'uomo, ma sulla base di studi sperimentali sugli animali, la riddelliina è classificata come un composto del gruppo 2B, il che significa che è possibilmente cancerogena per l'uomo.[11]
Effetti sugli animali
modificaLa riddelliina è tossica per gli animali, e l'ingestione il metodo di esposizione più comune. In particolare, la riddelliina ha un effetto cancerogeno su ratti e topi. Nei ratti, la somministrazione orale di riddelliina ha portato ad un aumento di emangiosarcomi nel fegato, carcinomi cellulari e/o adenomi nel fegato e leucemia a cellule mononucleate.[11] Nei topi, la somministrazione orale di riddelliina ha portato a emangiosarcomi nel fegato nei maschi e ad adenomi e carcinomi bronco-alveolari nelle femmine.[11] Inoltre, durante uno studio di 5 e 30 giorni, in cui ratti e topi sono stati alimentati forzatamente con riddelliina, si è verificata una sintesi del DNA non programmata negli epatociti coltivati in ratti e topi maschi e femmine.[12]
È anche noto che la riddelliina disturba il ciclo estrale nei roditori.[11]
È stato anche osservato che la riddelliina aumenta le mutazioni nelle cellule endoteliali del fegato dei ratti. Uno studio ha osservato la caratteristica trasversione delle basi azotate da G: C a T: A, in cui le quantità di T: A erano aumentate dal 9% nel gruppo di controllo al 17% nei ratti trattati con riddelliina. Al contrario, la transizione G: C → A: T, la principale mutazione nei ratti di controllo che costituiva il 54% di tutte le mutazioni, è stata ridotta al 40% delle mutazioni nei ratti trattati con riddelliina all'interno dello stesso studio. Questi risultati suggeriscono che la mutagenicità relativamente elevata della riddelliina nelle cellule endoteliali del fegato di ratto può essere parzialmente responsabile della specificità cancerogena di questo agente.[13]
La tossicità è stata osservata anche nei batteri, in particolare nel batterio Salmonella typhimurium. Quando esposta alla riddelliina, la cellula batterica contiene molte mutazioni all'interno dei ceppi genetici.[5]
I segni clinici negli animali avvelenati includono effetti neurologici, gastrointestinali (diarrea) ed ematologici (ammoniaca nel sangue alta, emolisi). L'ascite è spesso osservata. Si è inoltre notato che i vitelli nutriti con Senecio riddellii, che contiene solo riddelliina e il suo N-ossido, per 20 giorni hanno mostrato perdita di peso, segni di depressione, ridotto consumo di mangime, atassia degli arti posteriori, ascite ed edema prima della morte.[14]
L'esame microscopico ha rivelato necrosi epatocellulare e collasso dei lobuli, aumento del numero di fibroblasti e collagene, edema portale, anisocariosi dei nuclei degli epatociti con una certa citomegalia e proliferazione dei dotti biliari.[5]
Indicazioni
modificaNei ratti trattati con riddelliina, un insieme di addotti del DNA della deidroretronecina (DHS) nel DNA epatico può servire come biomarcatore per la tumorigenicità indotta dalla riddelliina e dai relativi alcaloidi pirrolizidinici.[15]
Note
modifica- ^ a b (EN) Adams, I. Roger; Hamlin, K. E., Jr.; Jelinek, C. F.; Phillips, R. F., Structure of riddelliine, the alkaloid in Senecio riddellii, in Journal of the American Chemical Society, vol. 64, n. 12, 1942, pp. 2760–2763, DOI:10.1021/ja01264a013.
- ^ (EN) M. D. Nair and Roger Adams, The Structure of Riddellic Acid and the Stereochemistry of Necic Acids, in Journal of the American Chemical Society, vol. 83, n. 4, 1961, pp. 922–926, DOI:10.1021/ja01465a041.
- ^ NTP Technical Report on Toxicity Studies of Riddelliine Archiviato il 23 ottobre 2011 in Internet Archive., National Toxicology Program, Toxicity Report Series, Number 27
- ^ Program National Toxicology, Toxicology and carcinogenesis studies of riddelliine (CAS No. 23246-96-0) in F344/N rats and B6C3F1 mice (gavage studies), in National Toxicology Program Technical Report Series, n. 508, 2003, pp. 1–280, PMID 12844193.
- ^ a b c d Po Chan, NTP technical report on the toxicity studies of Riddelliine (CAS No. 23246-96-0) Administered by Gavage to F344 Rats and B6C3F1 Mice, in Toxicity Report Series, vol. 27, December 1993, pp. 1–D9, ISSN 1521-4621, PMID 12209179.
- ^ Richard H. F. Manske, The Alkaloids of Senecio Species: Iii. Senecio Integerrimus, S. Longilobus, S. Spartioides and S. Ridellii, in Canadian Journal of Research, 17b, n. 1, 1º gennaio 1939, pp. 1–7, DOI:10.1139/cjr39b-001, ISSN 1923-4287.
- ^ Adams, I. Roger, Hamlin, K. E., Jr., Jelinek, C. F. e Phillips, R. F., Structure of riddelliine, the alkaloid in Senecio riddellii , in Journal of the American Chemical Society, vol. 64, n. 12, 1942, pp. 2760–2763, DOI:10.1021/ja01264a013.
- ^ Riddelliine (PDF), su Report on Carcinogens. URL consultato il 4 dicembre 2018.
- ^ Journal of the Chemical Society, Chemical Communications, in Journal of the Chemical Society, Chemical Communications, DOI:10.1039/0022-4936/1972.
- ^ a b c Ming W. Chou, Yan Jian, Lee D. Williams, Qingsu Xia, Mona Churchwell, Daniel R. Doerge e Peter P. Fu, Identification of DNA Adducts Derived from Riddelliine, a Carcinogenic Pyrrolizidine Alkaloid, in Chemical Research in Toxicology, vol. 16, n. 9, 1º settembre 2003, pp. 1130–1137, DOI:10.1021/tx030018y, ISSN 0893-228X, PMID 12971801.
- ^ a b c d e f Publication, IARC Official., Some Traditional Herbal Medicines, Some Mycotoxins, Naphthalene and Styrene., Geneva, World Health Organization, 2002, ISBN 978-92-832-1589-9, OCLC 476191138.
- ^ Po C. Chan, Joseph K. Haseman, J. D. Prejean e Abraham Nyska, Toxicity and carcinogenicity of riddelliine in rats and mice, in Toxicology Letters, vol. 144, n. 3, 15 ottobre 2003, pp. 295–311, DOI:10.1016/S0378-4274(03)00240-6, ISSN 0378-4274, PMID 12927348.
- ^ Nan Mei, Lei Guo, Ruqing Liu, James C. Fuscoe e Tao Chen, Gene expression changes induced by the tumorigenic pyrrolizidine alkaloid riddelliine in liver of Big Blue rats, in BMC Bioinformatics, vol. 8, n. 7, 1º novembre 2007, pp. S4, DOI:10.1186/1471-2105-8-S7-S4, ISSN 1471-2105, PMC 2099496, PMID 18047727.
- ^ A. E. Johnson, R. J. Molyneux e L. D. Stuart, Toxicity of Riddell's groundsel (Senecio riddellii) to cattle, in American Journal of Veterinary Research, vol. 46, n. 3, March 1985, pp. 577–582, ISSN 0002-9645, PMID 3994126.
- ^ Yu-Ping Wang, Peter P. Fu e Ming W. Chou, Metabolic Activation of the Tumorigenic Pyrrolizidine Alkaloid, Retrorsine, Leading to DNA Adduct Formation In Vivo, in International Journal of Environmental Research and Public Health, vol. 2, n. 1, May 2005, pp. 74–79, DOI:10.3390/ijerph2005010074, ISSN 1661-7827, PMC 3814699, PMID 16705803.