Trimetilarsina
La trimetilarsina (trimetilarsano secondo la nomenclatura IUPAC) è un composto di organoarsenico(III), di formula As(CH3)3, abbreviata di solito come AsMe3 in reazioni che non coinvolgono direttamente i metili. Deriva formalmente dall'arsina (arsano) AsH3 per sostituzione degli idrogeni con gruppi metilici -CH3. In condizioni normali è un liquido incolore con un caratteristico odore spesso riportato come agliaceo, anche se questo non sembra accertato.[1] Viene usato in chimica organometallica come legante in complessi organometallici[2] , in particolare in complessi con il metallo in bassi stati di ossidazione, analogamente alle fosfine, altre arsine,[3] e come precursore di altri composti organici di arsenico. Questo composto volatile dell'arsenico è facilmente decomponibile e, in quanto tale, è usato come fonte di arsenico nell'industria dei semiconduttori in microelettronica.[4]
| Trimetilarsina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Trimetilarsano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H9As |
| Massa molecolare (u) | 120,03 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 209-815-8 |
| PubChem | 68978 |
| SMILES | C[As](C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,124 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | –87 °C (186 K) |
| Temperatura di ebollizione | 51 °C (324 K) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 7870 (topo, orale) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 23/25, 50/53 |
| Frasi S | 20/21, 28, 45, 60, 61 |
Storia
modificaAlla fine del XIX secolo il medico e microbiologo italiano Bartolomeo Gosio (1863–1944) sospettò che i coloranti all'arsenico usati allora in alcuni tipi di vernici e carte da parati fossero causa della morte inspiegabile di un gran numero di bambini. Egli trovò che in presenza di umidità il fungo Scopulariopsis brevicaulis produceva un gas tossico, riconoscibile dall'odore agliaceo, quando agiva su coloranti all'arsenico, e particolarmente sul verde di Parigi e il verde di Scheele utilizzati nelle carte da parati. Nel 1892 pubblicò un riassunto dei suoi risultati;[5] il gas tossico fu poi chiamato "gas di Gosio".
Nel 1933 la componente tossica fu identificata come trimetilarsina dal chimico Frederick Challenger,[6][7] e solo nel 1971 si dimostrò che la metilazione dell'arsenico era di origine batterica.[8][9] Studi più recenti mostrano tuttavia che la trimetilarsina ha una bassa tossicità, suggerendo che non sia tuttora nota con certezza la causa dei decessi e dei problemi alla salute osservati nel XIX secolo.[10]
Struttura e proprietà
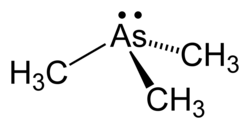
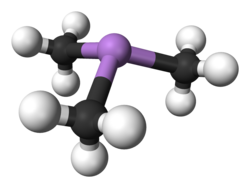
modificaLa trimetilarsina è un liquido incolore volatile, solubile in benzene ed altri solventi organici poco polari,[11] un po' più denso dell'acqua e insolubile in essa. La molecola ha struttura piramidale con angoli C–As–C di 91,83°, valore compatibile con l'uso di orbitali p pressoché puri da parte dell'atomo di As; la distanza di legame As–C ammonta a 151,9 pm.[12] Il basso valore di questo angolo di legame, anche più piccolo che nella trimetilfosfina PMe3 (98,6°[13]), indica che l'ibridazione degli orbitali atomici s e p di As in questa molecola è scarsa o nulla; di conseguenza la coppia solitaria rimane nell'orbitale s sottostante, anziché puntare all'esterno come nel caso della coppia solitaria in orbitale ibrido sp3 della molecola di ammoniaca. La molecola ha una certa polarità, μ = 0,86 D,[14] un po' minore di quella della trimetilfosfina (1,19 D),[15] molecola ad essa isoelettronica di valenza.
Sintesi
modificaLa trimetilarsina fu preparata per la prima volta nel 1854.[16] Si può ottenere trattando il triossido di diarsenico con trimetilalluminio:[17]
- As2O3 + 1,5 [AlMe3]2 → 2 AsMe3 + 3/n(MeAl-O)n
Reattività
modificaLa trimetilarsina è piroforica e si incendia all'aria, perché la reazione con ossigeno è fortemente esotermica:
- AsMe3 + ½ O2 → O=AsMe3
Presenza in natura
modificaLa trimetilarsina è prodotta per azione di microbi su composti inorganici dell'arsenico presenti naturalmente in rocce e terreni in concentrazione dell'ordine della parte per milione.[18] La trimetilarsina è stata individuata in tracce (parti per miliardo) nei gas sviluppati nelle discariche di rifiuti in Germania, Canada e Stati Uniti, ed è il principale composto arsenicale in questi gas.[19][20]
Indicazioni di sicurezza
modificaAsMe3 è disponibile in commercio. Il composto è tossico per inalazione ed ingestione, ed è irritante per pelle e mucose. È genotossico e cancerogeno per l'uomo. È molto tossico per gli organismi acquatici.[21][22][23][24]
Note
modifica- ^ (EN) Thomas G. Chasteen, Markus Wiggli e Ronald Bentley, Historical Review. Of garlic, mice and Gmelin: the odor of trimethylarsine, in Applied Organometallic Chemistry, vol. 16, n. 6, 2002-06, pp. 281–286, DOI:10.1002/aoc.299. URL consultato il 7 settembre 2022.
- ^ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, p. 553, ISBN 0-7506-3365-4.
- ^ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo e Manfred Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley Interscience, 1999, p. 421, ISBN 0-471-19957-5.
- ^ (EN) Masataka Hoshino, A mass spectrometric study of the decomposition of trymethylarsine (TMAs) with triethylgallium (TEGa), in Journal of Crystal Growth, vol. 110, n. 4, 1º aprile 1991, pp. 704–712, DOI:10.1016/0022-0248(91)90627-H. URL consultato il 7 settembre 2022.
- ^ Gosio 1892
- ^ Challenger et al. 1933
- ^ Challenger 1955
- ^ McBride e Wolfe 1971
- ^ Bentley e Chasteen 2002
- ^ Cullen e Bentley 2005
- ^ (EN) TRIMETHYLARSINE | 593-88-4, su ChemicalBook. URL consultato il 7 settembre 2022.
- ^ Wells 1984
- ^ (EN) Annette Schier e Hubert Schmidbaur, P-Donor LigandsBased in part on the article P-Donor Ligands by Charles A. McAuliffe & Anthony G. Mackie which appeared in the Encyclopedia of Inorganic Chemistry, First Edition ., John Wiley & Sons, Ltd, 15 marzo 2006, pp. ia177, DOI:10.1002/0470862106.ia177, ISBN 978-0-470-86078-6. URL consultato il 7 settembre 2022.
- ^ trimethylarsane, su www.stenutz.eu. URL consultato il 7 settembre 2022.
- ^ trimethylphosphane, su www.stenutz.eu. URL consultato il 7 settembre 2022.
- ^ Emsley 2005, p. 125.
- ^ Gavrilenko et al. 1996
- ^ Cullen e Reimer 1989
- ^ Feldmann e Cullen 1997
- ^ Pinel-Raffaitin et al. 2007
- ^ Sigma-Aldrich, 2007
- ^ Andrewes et al. 2003
- ^ Irvin e Irgolic 1995
- ^ Yamauchi et al. 1990
Bibliografia
modifica- P. Andrewes, K. T. Kitchin e K. Wallace, Dimethylarsine and Trimethylarsine Are Potent Genotoxins In Vitro, in Chem. Res. Toxicol., vol. 16, n. 8, 2003, pp. 994–1003, DOI:10.1021/tx034063h.
- R. Bentley e T. G. Chasteen, Microbial Methylation of Metalloids: Arsenic, Antimony, and Bismuth, in Microbiology and Molecular Biology Reviews, vol. 66, n. 2, 2002, pp. 250–271, DOI:10.1128/MMBR.66.2.250-271.2002. URL consultato il 10 gennaio 2012.
- F. Challenger, C. Higginbottom e L. Ellis, 32. The formation of organo-metalloid compounds by microorganisms. Part I. Trimethylarsine and dimethylethylarsine, in J. Chem. Soc., 1933, pp. 95-101, DOI:10.1039/JR9330000095.
- F. Challenger, Biological methylation, in Q. Rev. Chem. Soc., vol. 9, n. 3, 1955, pp. 255–286, DOI:10.1039/QR9550900255.
- W. R. Cullen e K. J. Reimer, Arsenic speciation in the environment, in Chem. Rev., vol. 89, n. 4, 1989, pp. 713–764, DOI:10.1021/cr00094a002.
- W. R. Cullen e R. Bentley, The toxicity of trimethylarsine: an urban myth, in J. Environ. Monit., vol. 7, n. 1, 2005, pp. 11–15, DOI:10.1039/b413752n.
- J. Emsley, The elements of murder, Oxford University Press, 2005, ISBN 978-0-641-82389-3.
- J. Feldmann e W. R. Cullen, Occurrence of Volatile Transition Metal Compounds in Landfill Gas: Synthesis of Molybdenum and Tungsten Carbonyls in the Environment, in Environ. Sci. Technol., vol. 31, n. 7, 1997, pp. 2125–2129, DOI:10.1021/es960952y.
- V. V. Gavrilenko, L. A. Chekulaeva, e I. V. Pisareva, Highly efficient synthesis of trimethylarsine, in Russian Chemical Bulletin, vol. 45, n. 8, 1996, pp. 2018–2019, DOI:10.1007/BF01457800.
- B. Gosio, Action of microphytes on solid compounds of arsenic: a recapitulation, in Science, vol. 19, n. 472, 1892, pp. 104-106.
- T. R. Irvin e K. J. Irgolic, In-vitro prenatal toxicity of trimethylarsine, trimethylarsine oxide and trimethylarsine sulfide, in Applied Organometallic Chemistry, vol. 9, n. 4, 1995, pp. 315-321, DOI:10.1002/aoc.590090404.
- B. C. McBride e R. S. Wolfe, Biosynthesisof dimethylarsine by a methanobacterium, in Biochemistry, vol. 10, 1971, pp. 4312-4317.
- P. Pinel-Raffaitin, I. Le Hecho, D. Amouroux e M. Potin-Gautier, Distribution and Fate of Inorganic and Organic Arsenic Species in Landfill Leachates and Biogases, in Environ. Sci. Technol., vol. 41, n. 13, 2007, pp. 4536–4541, DOI:10.1021/es0628506.
- A. F. Wells, Structural Inorganic Chemistry, 5ª ed., Oxford University Press, 1984, ISBN 978-0-19-855370-0.
- H. Yamauchi, T. Kaise, K. Takahashi e Y. Yamamura, Toxicity and metabolism of trimethylarsine in mice and hamsters, in Fundamental and Applied Toxicology, vol. 14, n. 2, 1990, pp. 399–407, DOI:10.1016/0272-0590(90)90219-A.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Trimetilarsina