Modificazione post traduzionale
Una modificazione post traduzionale è la modifica chimica di una proteina in seguito alla sua traduzione. Infatti, a volte, queste proteine hanno bisogno, per svolgere la propria funzione, di essere modificate[1].
Ogni proteina è un polipeptide composto da una catena in cui possono essere incorporati (durante la sintesi proteica vera e propria) 20 diversi amminoacidi. Molti di questi amminoacidi possono essere modificati attraverso l'aggiunta di alcuni gruppi funzionali in grado di allargare la funzionalità complessiva della proteina. Un ulteriore tipo di modificazione post-traduzionale è la rimozione di amminoacidi dalla regione N-terminale della proteina attraverso l'azione di una proteasi o anche la degradazione di una proteina in più parti, come l'insulina.
Allo stesso tempo, però, a volte le proteine possono essere prodotte separatamente per poi essere assemblate durante queste modificazioni, come ad esempio l'emoglobina.
Nel corso del tempo sono state identificate un numero notevole di modifiche post-traduzionali. Queste modifiche tendono a creare variazioni a livello delle funzionalità e delle caratteristiche stesse delle proteine, andando sicuramente ad intaccare la loro struttura tridimensionale, la loro attività, la loro localizzazione cellulare e la possibilità di interazioni con altre molecole, infatti una singola proteina può permanere nelle cellule in forme biologiche differenti[2].
Glicosilazione
modificaLa glicosilazione è il processo post-traduzionale più comune e diffuso, infatti è quello che determina la maggior parte delle modifiche proteiche, andando ad ampliare notevolmente il "corredo" proteosomico.[3]
Questa modifica prevede l'aggiunta di zuccheri a livello della catena polipeptidica e può avvenire in zone differenti della cellula, come ad esempio nel RER, ovvero il reticolo endoplasmatico rugoso o nell'apparato del Golgi. Inoltre, alcune di queste modifiche possono essere considerate modifiche co-traduzionali, ovvero che avvengono durante la sintesi della proteina stessa, come nel caso dell'N-glicosilazione.
Esistono vari tipi di glicosilazione:
- N-glicosilazione o N-linked: è la più frequente e rappresenta circa il 90% dei casi. Prevede l'aggiunta di un glicano pre-formato all'azoto ammidico dell'asparagina.
- O-glicosilazione o O-linked: è meno frequente della precente, anche se è quasi sempre sequenziale alla N-glicosilazione. Questa modifica prevede l'aggiunta di monosaccaridi a livello del gruppo idrossilico di serina e treonina. A volte avviene anche a livello di residui di idrossiprolina e di idrossilisina.
- Glipiazione: questo tipo di modifica è una glicosilazione di recente scoperta che si riscontra sia a livello di cellule eucariote, sia a livello degli archeobatteri. Questa modifica prevede la formazione di un legame covalente tra la proteina di partenza e il GPI (glicosilfosfatidilinositolo). Questo tipo di glicosilazione è fondamentale, in quanto serve a stabilizzare molecole solubile a livello della membrana plasmatica.
- C-glicosilazione o C-linked: questa modifica prevede il legame di una molecola di mannosio a livello dell'anello indolico del triptofano.
- Fosfoglicosilazione: questa modifica post-traduzionale prevede il legame di un glicano a livello di una serina, in questo caso mediante un legame fosfodiesterico.
Patologie correlate ad una glicosilazione anomala
modificaNegli ultimi anni è stato visto come difetti a livello del processo di glicosilazione siano alla base di molte patologie umane[3]:
- Disordini congeniti della glicosilazione: sono patologie che presentano disturbi neurologici e di sviluppo, determinate da un assemblaggio errato durante il processo di N-glicosilazione.
- Botulismo e colite pseudomembranosa: queste patologie sono correlate ad una tossina prodotte dal batterio Clostridium. Essa determina la glicosilazione della proteina Rho, fondamentale per l'organizzazione strutturale nelle cellule eucariotiche. Questa proteina è ad attività GTPasica e quindi per funzionare necessita di GTP, ma nel momento in cui il GTP si cerca di legare, ciò non riesce in maniera ottimale, in quanto la modifica ha determinato un'alterazione della struttura di legame.
- Trasformazioni neoplastiche: alcune proteine che vengono erroneamente glicosilate possono indurre le fasi del processo neoplastico, principalmente l'angiogenesi e la metastasi.
Fosforilazione
modificaLa fosforilazione è una modifica che consta nell'aggiunta a livello dei gruppi ossidrili di serina, treonina e tirosina di un gruppo fosfato. Questo meccanismo viene sviluppato da un enzima che prende il nome di chinasi. Il processo inverso prende il nome di defosforilazione e viene attuato da un altro enzima che prende il nome di fosfatasi. Questi due processi sono implicati nella modifica funzionale delle proteine, come ad esempio rendendole più inclini alla degradazione.
Questo processo però è interessante in quanto, grazie all'azione di un adeguato stimolo, la fosforilazione avviene rapidamente e con un raggio d'azione ampio[3].
Acetilazione
modificaL'acetilazione prevede l'aggiunta a livello di una lisina di un gruppo acetile che può derivare da diversi donatori, normalmente l'acetii-Coenzima-A.
Questa forma di modifica è fondamentale a livello istonico, in quanto contribuisce in modo decisivo allo sviluppo e al ripiegamento dei nucleosomi con successiva formazione della cromatina. Inoltre, concorre a regolare l'espressione genica in base alle necessità metaboliche della cellula.[3]
Metilazione
modificaLa metilazione prevede l'aggiunta di un gruppo metilico, grazie all'enzima metiltransferasi, su una lisina o un arginina (maggiore modifica a livello dei mammiferi). Inoltre, anche i gruppi carbossilici e le strutture N-terminali della proteina, anche se più raramente, possono essere attaccati dal gruppo metilico stesso. Questo gruppo metilico può derivare da donatori, quali ad esempio S-adenosilmetionina.
Questa forma di modifica è fondamentale, come l'acetilazione, a livello istonico.[3]
Nitrosilazione
modifica[3] La nitrosilazione o anche S-nitrosilazione prevede l'aggiunta covalente di una molecola di ossido d'azoto (NO) a livello di una cisteina e in casi rari a livello del triptofano e di gruppi amminici, composti della lisina e dell'N-terminale della proteina. Questa modifica avviene prevalentemente in presenta di alte quantità di ossigeno, in quanto la cisteina e NO non presentano un'elevata reattività.
A differenza di altre modifiche, questa presenta una peculiarità, ovvero non è catalizzata da enzimi, ma dipende dalla reattività chimica delle molecole di NO e dell'accettore d'interesse.
ADP-ribosilazione
modifica[3]L'ADP-ribosilazione prevede l'aggiunta di una o più molecole di ADP-ribosio mediante differenti enzimi:
- La mono ADP-ribosiltransferasi aggiunge una molecola di ADP-ribosio al residuo amminoacidico di arginina.
- La poli ADP-ribosilpolimerasi lega le unità di ADP-ribosio attraverso un legame 1"-2' e successivamente assembla il polimero a livello di residui amminoacidici differenti in base alla proteina bersaglio.
Queste modifiche sono entrambe reversibili: la prima grazie all'azione di ADP-ribosilidrossilasi, mentre la seconda mediante specifiche idrolasi. Questa modifica è fondamentale nei processi di modulazione dell'espressione genica e anche di eventi di riparazione del DNA, di tumorigenesi e di apoptosi.
Un aspetto interessate riguardo a questa modifica post-traduzionale è come possa essere la causa della tossicità e patogenicità di alcuni batteri, come ad esempio il Coeynebacterium diphteriae. La sua pericolosità è dovuta dal fatto che la tossina da esso prodotta ha un'attività ADP-ribosiltransferasi. Questa tossina catalizza la modificazione (ADP-ribosilazione) su un residuo di istidina di un fattore implicato nella fase di allungamento della traduzione, determinando il blocco della sintesi proteica e quindi l'apoptosi cellulare.
Prenilazione
modificaLa prenilazione o lipidazione consiste nell'aggiunta di un gruppo lipidico a una catena polipeptidica tramite legame covalente[3]. Questo processo può avvenire sia a livello delle porzioni N-terminale e C-terminale delle proteine, ma anche a livello delle catene laterali.[4]
La lipidazione incrementa l'idrofobicità delle proteine provocando modifiche alla loro conformazione, stabilità, associazione di membrana, localizzazione, traffico e affinità di legame con i loro cofattori.[5]
Le proteine possono modificare in modo covalente da almeno sette tipi di lipidi:[6]
- Acidi grassi: come ad esempio la mirisitilazione e palmitilazione
- acidi lipoici: questa modifica si riscontra prevalentemente associata a tumori, disordini metabolici e malattie mentali.
- Isoprenoidi
- Steroli, come per esempio l'aggiunta di colesterolo, prevalentemente al dominio C-terminale
- Fosfolipidi
- Glicosilfosfatidilinositolo (GPI)
- Elettrofili derivati dai lipidi (LDE)
Proteolisi
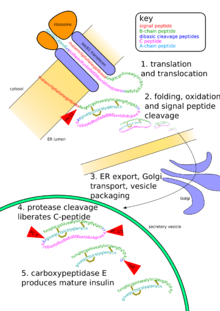
modificaLa proteolisi è stata considerata per molto tempo un processo soltanto degradativo. In realtà oggi è chiaro che si tratta di un processo ubiquitario che rientra nella categoria delle modifiche post-traduzionali delle proteine di tipo irreversibile. Sono molti i processi in cui proteine, enzimi e ormoni vengono attivati all'interno di processi cellulari. Un esempio è quello dell'insulina, peptide responsabile del corretto assorbimento del glucosio.
L'insulina viene prodotta dalle cellule β del pancreas sottoforma di un precursore inattivo, cioè la pre-proinsulina formata da 110 amminoacidi. Quest'ultima mediante la formazione di ponti disolfuro tra i suoi amminoacidi si trasforma in proinsulina, formata da 79 a 86 amminoacidi a seconda della specie animale. Questa catena è composta da tre segmenti:
- N-terminale che prende il nome di catena B
- C-terminale che prende il nome di catena A
- Il segmento intermedio che prende il nome di peptide C.
Il peptide C viene rimosso attraverso un taglio proteolitico da parte di un endopeptidasi con la formazione dell'insulina attiva.[7]
Note
modifica- ^ (IT) Campbell, Biologia e genetica, Ed.10, Pearson, 1º settembre 2015, ISBN 8865189320.
- ^ (IT) Gerald Karp, Biologia cellulare e molecolare, concetti ed esperimenti, a cura di E.Ginelli, Ed.5, Edises, 1º marzo 2015, ISBN 8879598635.
- ^ a b c d e f g h G.Capranico, Biologia Molecolare, Edises, 1º ottobre 2016, ISBN 978-8879599160.
- ^ (EN) Wang, R. e Chen, Y. Q., Protein Lipidation Types: Current Strategies for Enrichment and Characterization., in International journal of molecular sciences, 2022 Febbraio, PMID 35216483.
- ^ Baoen Chen, Yang Sun e Jixiao Niu, Protein Lipidation in Cell Signaling and Diseases: Function, Regulation, and Therapeutic Opportunities, in Cell Chemical Biology, vol. 25, n. 7, 19 luglio 2018, pp. 817–831, DOI:10.1016/j.chembiol.2018.05.003. URL consultato il 18 maggio 2023.
- ^ Sakamaki, J. I. e Mizushima, N., Cell biology of protein-lipid conjugation. Cell structure and function, 2023, PMID 37019684.
- ^ (IT) P.H. Raven, G.B Johnson K.A. Mason, J.B.Loso, S.R.Siger, Genetica e Biologia Molecolare, Ed.2, Piccin-Nuova Libreria, 1º ottobre 2018, ISBN 8829929522.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su modificazione post traduzionale