Utente:Alb.csr/Sandbox
| Alb.csr/Sandbox | |
|---|---|
 | |
| Nome IUPAC | |
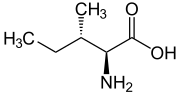
| L-isoleucina | |
| Abbreviazioni | |
| I Ile | |
| Nomi alternativi | |
| acido (2S,3S)-2-ammino-3-metilpentanoico | |
| Caratteristiche generali | |
| Massa molecolare (u) | 131,17 |
| Aspetto | solido cristallino bianco |
| Numero CAS | |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 293 K | pK1: 2,32 pK2: 9,76 |
| Punto isoelettrico | 6,05 |
| Solubilità in acqua | 32,1 g/l a 293 K |
| Temperatura di fusione | 279 °C (552 K) con decomposizione |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −637,8 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
L'isoleucina (simbolo Ile o I)[2] è un α-amminoacido, la sua molecola è chirale. Contiene un α-ammino gruppo (protonato a −NH+3 in condizioni fisiologiche), un gruppo carbossilico (deprotonato a −COO- in condizioni fisiologiche) e una catena laterale alifatica, un sec-butile, classificata come apolare e non carica (a pH fisiologico). In condizioni fisiologiche si trova perciò in forma zwitterionica.
L'enantiomero L è uno dei 20 amminoacidi ordinari e si riferisce allo stereoisomero acido-(2S,3S)-2-amino-3-metilpentanoico: questa è la configurazione naturale.
È un amminoacido essenziale negli umani, infatti il corpo non può sintetizzarlo e deve quindi essere assunto con la dieta. L'isoleucina è sintetizzata in altri organismi, come i batteri, a partire dal piruvato utilizzando enzimi biosintetici della leucina[3]. Nella trascrizione genetica è codificata nei codoni ATT, ATC, ATA.
La presenza di questo amminoacido nella composizione media delle proteine di organismi eucarioti varia tra il 3% e il 9%[4], dipendentemente dal regno tassonomico di origine.
Metabolismo
modificaBiosintesi
modificaEssendo un nutriente essenziale (non sintetizzato dal corpo umano), l'isoleucina deve essere assunta con la dieta, solitamente come componente di proteine. Nelle piante e nei microrganismi è sintetizzata in vari passaggi, partendo da acido piruvico e alpha-chetoglutarato. Gli enzimi coinvolti in questa biosintesi includono[5]:
- Acetolattato sintasi
- Acido idrossiacetico isomeroreduttasi
- Acido didrossilico deidrasi [6]
- Valina amminotransferasi
Catabolismo
modificaL'isoleucina è un amminoacido sia glucogenico sia chetogenico. Dopo la transaminazione con alpha-ketoglutarato la catena laterale alifatica può essere convertita sia in succinil-coenzima A, e inserita nel ciclo dell'acido citrico per l'ossidazione, o convertita in acido ossalacetico per la gluconeogenesi (perciò glucogenico). Può anche essere convertita in acetil-coenzima A e inserita nel ciclo dell'acido citrico per condensazione con acido ossalacetico per formare citrato. Nei mammiferi l'acetil-coenzima A non può essere riconvertito a carboidrato ma può essere usato nella sintesi di corpi chetonici o acidi grassi, perciò l'isoleucina è un amminoacido chetogenico[7].
L'incapacità di metabolizzare l'isoleucina, insieme a altri amminoacidi, è associata con la malattia MSUD che consiste nella decolorazione delle urine del paziente e nell'odore caratteristico di queste, da cui deriva il nome della patologia. Nei casi più gravi, la malattia può portare a danni a cellule nervose e al decesso[8].
Resistenza all'insulina
modificaL'isoleucina, come gli altri amminoacidi a catena ramificata, è associata con la resistenza all'insulina: nel sangue di topi, ratti e umani affetti da diabete si osservano livelli più alti di isoleucina[9]. Nei topi, una dieta giornaliera mancante di isoleucina migliora la sensibilità all'insulina, mentre una dieta settimanale di questo tipo abbassa significativamente i livelli di glucosio nel sangue[10]. In topi affetti da obesità indotta da dieta e resistenti all'insulina, una dieta con livelli diminuiti di isoleucina e di altri amminoacidi a catena ramificata porta a una riduzione dell'adiposità e a un miglioramento della sensibilità all'insulina[11].
Fabbisogno giornaliero
modificaIl fabbisogno giornaliero raccomandato dall'Organizzazione mondiale della sanità per questo amminoacido essenziale è 20 mg/kg di peso corporeo[12]. Ad esempio, il valore raccomandato per un individuo di 70 kg è 1400 mg.
Fonti nutrizionali
modificaSebbene questo amminoacido non sia biosintetizzato dagli animali, esso è presente in grandi quantità anche in alimenti di origine animale. Gli alimenti con più alto contenuto di isoleucina includono: uova, proteine della soia, alga marina, tacchino, pollo, agnello, formaggio e pesce[13].
Stereoisomeri
modificaL'isoleucina fa parte, assieme alla treonina, della ristretta famiglia di α-amminoacidi naturali contenenti due centri stereogenici. I possibili stereoisomeri sono quattro e posseggono rispettivamente configurazione assoluta: (2S,3S), (2R,3R), (2S,3R) e (2R,3S). Quando si parla di L-treonina ci si riferisce allo stereoisomero (2S,3R), il più rappresentato in natura.
| Nome | L-isoleucina | D-Isoleucina | L-allo-Isoleucina | D-allo-Isoleucina |
|---|---|---|---|---|
| Struttura | ||||
| Nome IUPAC | Acido (2S,3S)-2-ammino-3-metilpentanoico
(S)-Isoleucina |
Acido (2R,3R)-2-ammino-3-metilpentanoico
(R)-Isoleucina |
Acido (2S,3R)-2-ammino-3-metilpentanoico | Acido (2R,3S)-2-ammino-3-metilpentanoico |
| Numero CAS | 73-32-5 | 319-78-8 | 1509-34-8 | 1509-35-9 |
| PubChem CID NCBI | 6306 | 76551 | 99288 | 94206 |
| Punto di fusione | Decomposizione: 284 °C IFA-GESTIS |
Sintesi
modificaL'isoleucina può essere sintetizzata in un processo a più stadi partendo da 2-bromobutano e dietilmalonato[14]. L'isoleucina sintetica fu segnalata per la prima volta nel 1905 dal chimico francese Louis Bouveault[15].
Il chimico tedesco Felix Ehrlich scoprì l'isoleucina nella melassa della barbabietola nel 1903[16].
Note
modifica- ^ scheda dell'isoleucina su IFA-GESTIS
- ^ Nomenclature and Symbolism for Amino Acids and Peptides, su chem.qmul.ac.uk, IUPAC-IUB Joint Commission on Biochemical Nomenclature, 1983. URL consultato il 5 March 2018 (archiviato il 9 October 2008).
- ^ (EN) Kisumi M, Komatsubara S, Chibata I, Pathway for isoleucine formation form pyruvate by leucine biosynthetic enzymes in leucine-accumulating isoleucine revertants of Serratia marcescens, in Journal of Biochemistry, vol. 82, n. 1, July 1977, pp. 95–103.
- ^ (EN) Gaur, Rajneesh Kumar., "Amino acid frequency distribution among eukaryotic proteins.", in The IIOAB Journal, 5: Issue 2, 2014, pp. 6-11.
- ^ (EN) David L. Nelson e Michael M. Cox, Lehninger Principles of Biochemistry, Terza edizione, Worth Publishing, 2000, ISBN 9781572599314.
- ^ (EN) Myers J. W., Dihydroxy acid dehydrase: an enzyme involved in the biosynthesis of isoleucine and valine, in The Journal of Biological Chemistry, vol. 236, n. 5, 1961, pp. 1414-1418.
- ^ (EN) Jeffrey T. Cole, Chapter 2: Metabolism of BCAAs, in Branched Chain Amino Acids in Clinical Nutrition, ISBN 978-1-4939-1923-9.
- ^ (EN) Maple Syrup Urine Disease (MSUD), su learn.genetics.utah.edu. URL consultato l'8 dicembre 2015 (archiviato dall'url originale il 10 dicembre 2015).
- ^ (EN) Lynch CJ, Adams SH, Branched-chain amino acids in metabolic signalling and insulin resistance, in Nature Reviews. Endocrinology, vol. 10, n. 12, December 2014, pp. 723–36, DOI:10.1038/nrendo.2014.171.
- ^ (EN) Xiao F, Yu J, Guo Y, Deng J, Li K, Du Y, Chen S, Zhu J, Sheng H, Guo F, Effects of individual branched-chain amino acids deprivation on insulin sensitivity and glucose metabolism in mice, in Metabolism, vol. 63, n. 6, June 2014, pp. 841–50, DOI:10.1016/j.metabol.2014.03.006.
- ^ (EN) Cummings NE, Williams EM, Kasza I, Konon EN, Schaid MD, Schmidt BA, Poudel C, Sherman DS, Yu D, Arriola Apelo SI, Cottrell SE, Geiger G, Barnes ME, Wisinski JA, Fenske RJ, Matkowskyj KA, Kimple ME, Alexander CM, Merrins MJ, Lamming DW, Restoration of metabolic health by decreased consumption of branched-chain amino acids, in The Journal of Physiology, December 2017, DOI:10.1113/JP275075.
- ^ (EN) FAO/WHO/UNU, PROTEIN AND AMINO ACID REQUIREMENTS IN HUMAN NUTRITION (PDF), su whqlibdoc.who.int, WHO Press, 2007., pagina 150
- ^ (EN) Foods highest in Isoleucine, in Self Nutrition Data, Condé Nast.«List is in order of highest to lowest of per 200 Calorie serving of the food, not volume or weight.»
- ^ (EN) dl-Isoleucine, in Organic Syntheses, vol. 21, n. 60, 1941, DOI:10.15227/orgsyn.021.0060.
- ^ (FR) L. Bouveault, Action du sodium sur les éthers des acides monobasiques à fonction simple de la série grasse, in Comptes Rendus Chimie, vol. 140, 1905, pp. 1593-1595.
- ^ (DE) F. Ehrlich: Ueber das natürliche Isomere des Leucins. Konstitution und Synthese des Isoleucins. In: Ber Deutschen Chem Ges, Band 40(2), S. 2538–2562 (1907), doi:10.1002/cber.190704002181.
Bibliografia
modifica- (EN) David L. Nelson e Michael M. Cox, Lehninger Principles of Biochemistry, Terza edizione, Worth Publishing, 2000, ISBN 9781572599314.
Voci correlate
modificaAltri progetti
modifica- Wikizionario contiene il lemma di dizionario «Alb.csr/Sandbox»